引言:内容包含人教版九年级化学知识点下册内容,适合新授课期间使用,内容比较全面,非重点知识也包含在内。内容纯手打,不可避免会出现错误,希望您能帮助完善此内容,纠错请在底部留言,或发送邮件到whutlike@163.com
版权声明:如未特别说明,本网站所有内容均为原创,您可以使用本网站所有内容,但是禁止转发到其他平台
第八单元 金属和金属材料
8.1 金属材料
一、金属材料
金属材料包括纯金属和合金
1.纯金属
使用先后顺序:Cu Fe Al
年产量:Fe Al Cu
2.合金
铁合金、铝合金、钛合金、金合金……
二、金属的物理性质 (手动水印-微信公众号:每日一化学)
1.共性
常温下为固体(汞为液体)
有颜色(大多为银白色,铜:紫红色、金:黄色、铁粉:黑色)
有光泽、熔点高、硬度大
有良好的导电性、导热性、延展性
2.特性
导电性、导热性最好的金属-银(Ag)
熔点最高的金属-钨(W)
熔点最低的金属-汞(Hg)
密度最大的金属-锇(Os)
密度最小的金属-锂(Li)
硬度最大的金属-铬(Cr)
地壳中含量最高的金属-铝(Al)
人体含量最高的金属-钙(Ca)
年产量最高的金属-铁(Fe)
三、合金 (手动水印-微信公众号:每日一化学)
概念:一种金属中加热熔合某些金属或非金属,得到具有金属特性的物质
合金为混合物,至少含有一种金属
1.铁合金
(1)生铁(含碳量2%-4.3% ):Fe、C、Si、Mn
(2)钢 (含碳量0.03%-2%) :不锈钢(Fe、C、Cr、Ni)、锰钢(Fe、C、Mn)
2.钛合金-21世纪的重要金属材料
性质:熔点高、密度小、可塑性好、机械性能好、抗腐蚀性好
用途:火箭、导弹、航天器、船舶、化工设备、通信设备和医疗等
四、合金的优越性能
硬度高、抗腐蚀性强、熔点低于纯金属
8.2 金属的化学性质
一、金属活动性顺序
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
1.在金属活动性顺序里,金属的位置越靠前它的活动性就越强
2.K、Ca、Na因为能与水反应,比较特殊,不考虑他们与酸、盐溶液的反应
3.在金属活动性顺序里,氢前金属(活泼金属)能置换出盐酸、硫酸中的氢
4.在金属活动性顺序里,位于前面的金属能把位于后面的金属从它们的盐溶液里置换出来
口诀:前换后,盐可溶,钾钙钠除外
二、金属的化学性质 (手动水印-微信公众号:每日一化学)
1.金属与氧气反应
大多数金属都能与氧气反应,但反应的难易程度不同
(1)某些金属(Mg、Al)常温下就能与氧气反应
$\ce{2Mg + O2}\xlongequal{}\ce{2MgO}$
$\ce{4Al + 3O2}\xlongequal{}\ce{2Al2O3}$
(2)某些金属(Fe、Cu)高温下才能与氧气反应
$\ce{3Fe + 2O2}\xlongequal{点燃}\ce{Fe3O4}$
$\ce{2Cu + O2}\xlongequal{\Delta}\ce{2CuO}$
(3)某些金属(Au)高温也不与氧气反应
真金不怕火炼
结论:镁、铝比较活泼,铁、铜次之,金最不活泼
注意:金属活动性不能等同于活泼与否,但在初中,基本相同
(4)为什么铝的耐腐蚀性好
铝在空气中与氧气反应,生成一层致密的氧化铝薄膜,阻止铝进一步氧化
2.金属与酸反应
在金属活动性顺序里,氢前金属(活泼金属)能置换出盐酸、硫酸中的氢
(1)镁与稀盐酸、稀硫酸
现象:反应剧烈,产生大量气泡
化学方程式:
$\ce{Mg + 2HCl}\xlongequal{}\ce{MgCl2 + H2 ^}$
$\ce{Mg + H2SO4}\xlongequal{}\ce{MgSO4 + H2 ^}$
(2)铝与稀盐酸、稀硫酸
现象:反应剧烈,产生大量气泡
化学方程式:
$\ce{2Al + 6HCl}\xlongequal{}\ce{2AlCl3 + 3H2 ^}$
$\ce{2Al + 3H2SO4}\xlongequal{}\ce{2Al2(SO4)3 + 3H2 ^}$
(3)锌与稀盐酸、稀硫酸
现象:反应较剧烈,有较多气泡产生
化学方程式:
$\ce{Zn + 2HCl}\xlongequal{}\ce{ZnCl2 + H2 ^}$
$\ce{Zn + H2SO4}\xlongequal{}\ce{ZnSO4 + H2 ^}$
(4)铁与稀盐酸、稀硫酸
现象:反应缓慢,有少量气泡产生,溶液由无色变为浅绿色
化学方程式:
$\ce{Fe + 2HCl}\xlongequal{}\ce{FeCl2 + H2 ^}$
$\ce{Fe + H2SO4}\xlongequal{}\ce{FeSO4 + H2 ^}$
(5)铜与稀盐酸、稀硫酸
现象:无明显变化
化学方程式:无
结论:镁、铝、锌、铁的金属活动性比铜强,它们能置换出盐酸或稀硫酸中的氢
3.金属与盐溶液反应 (手动水印-微信公众号:每日一化学)
在金属活动性顺序里,位于前面的金属能把位于后面的金属从它们的盐溶液里置换出来
(1)将铝丝浸入到硫酸铜溶液中
现象:铝丝表面有红色固体析出(溶液由蓝色变为无色或溶液颜色变浅~根据题目意思回答)
化学方程式:
$\ce{2Al + 3CuSO4}\xlongequal{}\ce{Al2(SO4)3 + 3Cu}$
结论:金属活动性Al>Cu
(2)将铜丝浸入到硝酸银溶液中
现象:铜丝表面有银白色物质析出,溶液由无色变为蓝色
化学方程式:
$\ce{Cu + 2AgNO3}\xlongequal{}\ce{Cu(NO3)2 + 2Ag}$
结论:金属活动性Cu>Ag
(3)将铜丝浸入到硫酸铝溶液中
现象:无明显现象
化学方程式:无
结论:金属活动性Cu<Al
注意:
铝丝、铜需要用砂纸打磨光亮,目的是除去其表面的氧化膜和杂质。
Fe2+浅绿色,Fe3+黄色,Cu2+蓝色,描述现象时注意溶液颜色的变化。
强调金属与盐溶液反应,若盐不能溶于水,则不能发生反应,例如铜不能置换出AgCl(不溶于水)中的银
三、置换反应 (手动水印-微信公众号:每日一化学)
1.概念:由一种单质与一种化合物反应,生成另一种单质与另一种化合物的反应叫置换反应
2.通式:A+BC=AC+B
3.特点:单化化单
4.举例:金属与酸、盐溶液的反应,碳、氢气还原金属氧化物。特别注意一氧化碳还原金属氧化物不是置换反应。
注意:置换反应化学方程式的书写,不需要记忆,掌握方法后可直接写出
8.3 金属资源的利用和保护
一、金属资源的概况
1.金属资源广泛的存在于地壳和海洋中
地壳中含量最多的金属元素Al(O、Si、Al、Fe)
2.极少数不活泼的金属(Au、Ag)以单质的形式存在,其余都以化合物的形式存在
3.几种矿石
赤铁矿(Fe2O3 ) ,磁铁矿(Fe3O4 ) ,铝土矿(Al2O3)
二、铁的冶炼 (手动水印-微信公众号:每日一化学)
1.实验室模拟炼铁
(1)实验装置图
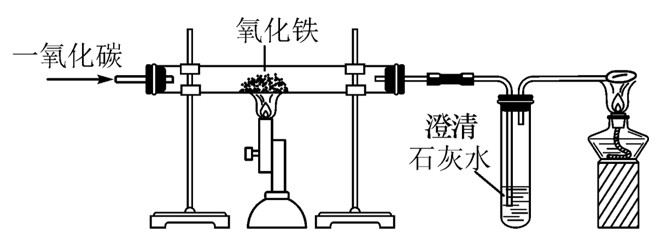
(2)反应原理
$\mathrm{\ce{3CO + Fe2O3}\xlongequal{高温}\ce{2Fe + 3CO2}}$
(3)现象
红色(红棕色)粉末变为黑色
澄清石灰水变浑浊
气体被点燃,火焰呈蓝色
(4)注意事项
尾部的酒精灯作用:CO有毒,防止污染空气(处理尾气,防止污染空气)
尾气处理的方式:点燃尾气;用气球收集
CO先来后走:实验开始时,先通CO,后点燃酒精喷灯;实验结束时,先熄灭酒精喷灯,后停止通入CO
CO先来的原因:排尽装置内的空气,防止混有CO的空气加热时发生爆炸
CO后走的原因:防止生成的铁重新被氧化;防止液体倒吸,使玻璃管炸裂
(5)相关化学方程式
$\mathrm{\ce{CO2 + Ca(OH)2}\xlongequal{}\ce{CaCO3 v + H2O}}$
$\mathrm{\ce{2CO + O2}\xlongequal{点燃}\ce{2CO2}}$
2.工业炼铁
(1)原料:
铁矿石(赤铁矿、磁铁矿)
焦炭:产生还原剂CO,提供热量
石灰石:将矿石中二氧化硅转变为炉渣
(2)相关化学方程式
$\mathrm{\ce{C + O2}\xlongequal{高温}\ce{CO2}}$
$\mathrm{\ce{C + CO2}\xlongequal{高温}\ce{2CO}}$
$\mathrm{\ce{3CO + Fe2O3}\xlongequal{高温}\ce{2Fe + 3CO2}}$
三、铁制品锈蚀的条件 (手动水印-微信公众号:每日一化学)
1.铁锈的主要成分:Fe2O3·xH2O
2.铁钉生锈的条件探究
(1)实验装置图
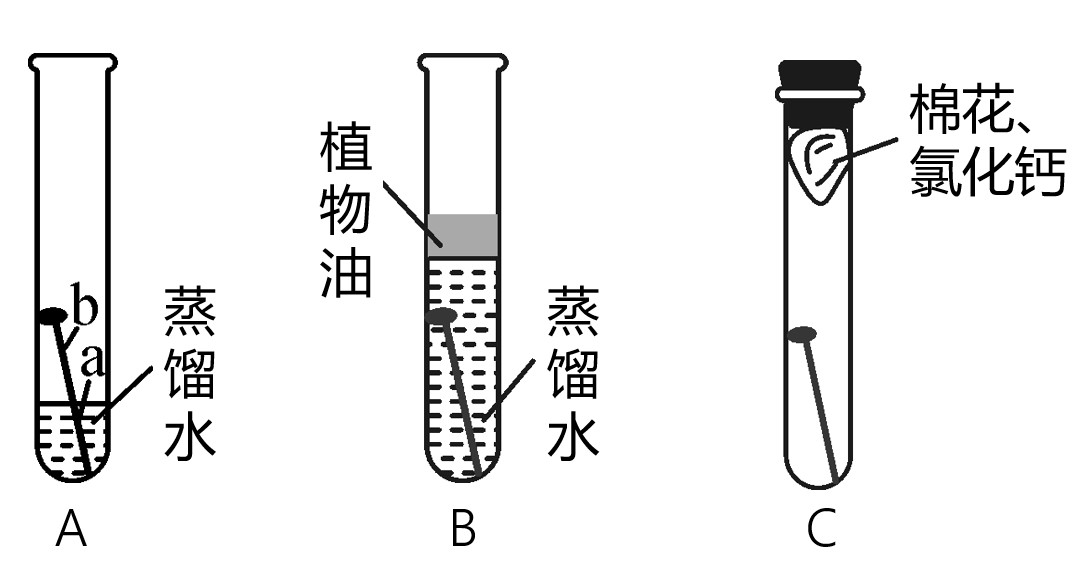
(2)现象及分析
A:铁钉生锈,a处锈蚀最严重
B:铁钉没有生锈(未与氧气接触)
C:铁钉没有生锈(未与水接触)
A、B对比:铁生锈需要氧气
A、C对比:铁生锈需要水
(3)结论
铁制品锈蚀的过程,是铁与空气中的氧气、水蒸气等发生化学反应的过程
铁生锈的条件:与氧气接触和与水接触
(4)注意
为什么用蒸馏水:除去溶解在水中的氧气,避免对实验造成干扰
氯化钙的作用:除去空气中的水
3.防止铁生锈的方法(破坏铁生锈条件)
防氧气,防水:保持铁制品干燥;刷油漆;涂油;镀其他耐腐蚀金属
四、金属资源的保护
1.为什么要保护金属
金属矿物的储量有限,而且不能再生
2.怎样保护金属资源
(1)防止金属腐蚀
(2)回收利用废旧金属(节约金属,减少环境污染)
(3)有计划、合理的开采矿物
(4)寻找金属的代用品
第九单元 溶液
9.1 溶液及其应用
一、溶液 (手动水印-微信公众号:每日一化学)
1.溶液的概念
蔗糖溶于水:蔗糖分子分散到水分子中间
氯化钠溶于水:钠离子和氯离子分散到水分子中间
一种或几种物质分散到另一种物质里,形成均一的、稳定的、混合物,叫做溶液
2.溶液的理解
均一的:溶液各部分的性质、组成完全相同
稳定的:外界条件不变,溶液成分不会发生改变
混合物:溶液由溶质和溶剂组成,至少含有两种物质,一定是混合物,水不是溶液
3.溶液的组成
溶液由溶剂和溶质组成
溶剂:能溶解其他物质的物质叫做溶剂
溶质:被溶解的物质叫做溶质
水是最常用的溶剂
4.溶质与溶剂的判断
溶质:固体、液体、气体
溶剂:一般为液体
固体、气体溶于液体:固体、气体为溶质
液体溶于液体:有水,水为溶剂;无水,量多的为溶剂
未指明溶剂的溶液,溶剂为水
5.同一种物质在不同溶剂中的溶解性是不同的,不同的物质在同一溶剂中的溶解性也是不同的
二、溶解时的吸热放热现象
物质在溶解过程中通常会伴随着热量的变化,有些物质在溶解时会出现吸热的现象,有些物质在溶解时会出现放热现象
溶解时吸热:NH4NO3
溶解时放热:NaOH
温度几乎变:NaCl
三、溶液的应用
1.将固体反应物配成溶液后反应,以加快反应的进行
2.医疗上,配置葡萄糖溶液、生理盐水、眼药水
3.农业上,无土栽培
9.2 溶解度
一、饱和溶液
1.概念
在一定温度下,向一定量溶剂里加入某种溶质,当溶质不能继续溶解时,所得到的溶液叫做这种溶质的饱和溶液;还能继续溶解的溶液,叫做这种溶质的不饱和溶液
2.概念的理解
(1)改变溶剂量和温度,都能改变溶解物质的多少,因此只有在一定温度下、一定量溶剂里,谈饱和溶液,不饱和溶液才有意义
(2)这种溶质的饱和溶液的理解:饱和的氯化钠溶液还能溶解少量硝酸钾,对于氯化钠而言是饱和溶液,而对于硝酸钾而言是不饱和溶液,所以是这种溶质的饱和溶液
3.饱和溶液与不饱和溶液的判断
(1)若某种固体未溶解,对于这种物质而言一定是饱和溶液
(2)若无固体未溶解,则存在两种状态,分别为不饱和溶液和恰好饱和
我们可以加入少量该溶质,如果溶解,是不饱和溶液;如果没有溶解,是饱和溶液
或者蒸发少量溶剂,如果没有固体析出,是不饱和溶液;如果有固体析出,是饱和溶液
4.饱和溶液与不饱和溶液的转换
饱和溶液转化为不饱和溶液:升高温度、增加溶剂
不饱和溶液转变为饱和溶液:增加溶质、降低温度、蒸发溶剂
注意:这里的改变温度不一定靠谱,需根据溶解度曲线具体判断
二、结晶 (手动水印-微信公众号:每日一化学)
1.概念
溶质从溶液中以晶体的形式析出,这一过程叫做结晶
2.结晶方法
降温结晶、蒸发结晶
三、固体溶解度
1.概念
在一定温度下,某固体物质在100g溶剂里达到饱和状态时,所溶解的质量
2.四要素
温度:不指定温度,谈溶解度是没有意义的
溶剂量:100g
饱和状态:要溶解到不能溶解为止
单位:g
3.举例:20℃时氯化钠的溶解度为36g
意义:
20℃ ,氯化钠在100g水中,达到饱和状态,溶解的质量为36g
20℃ ,100g水中,最多只能溶解36g氯化钠
四、溶解度曲线
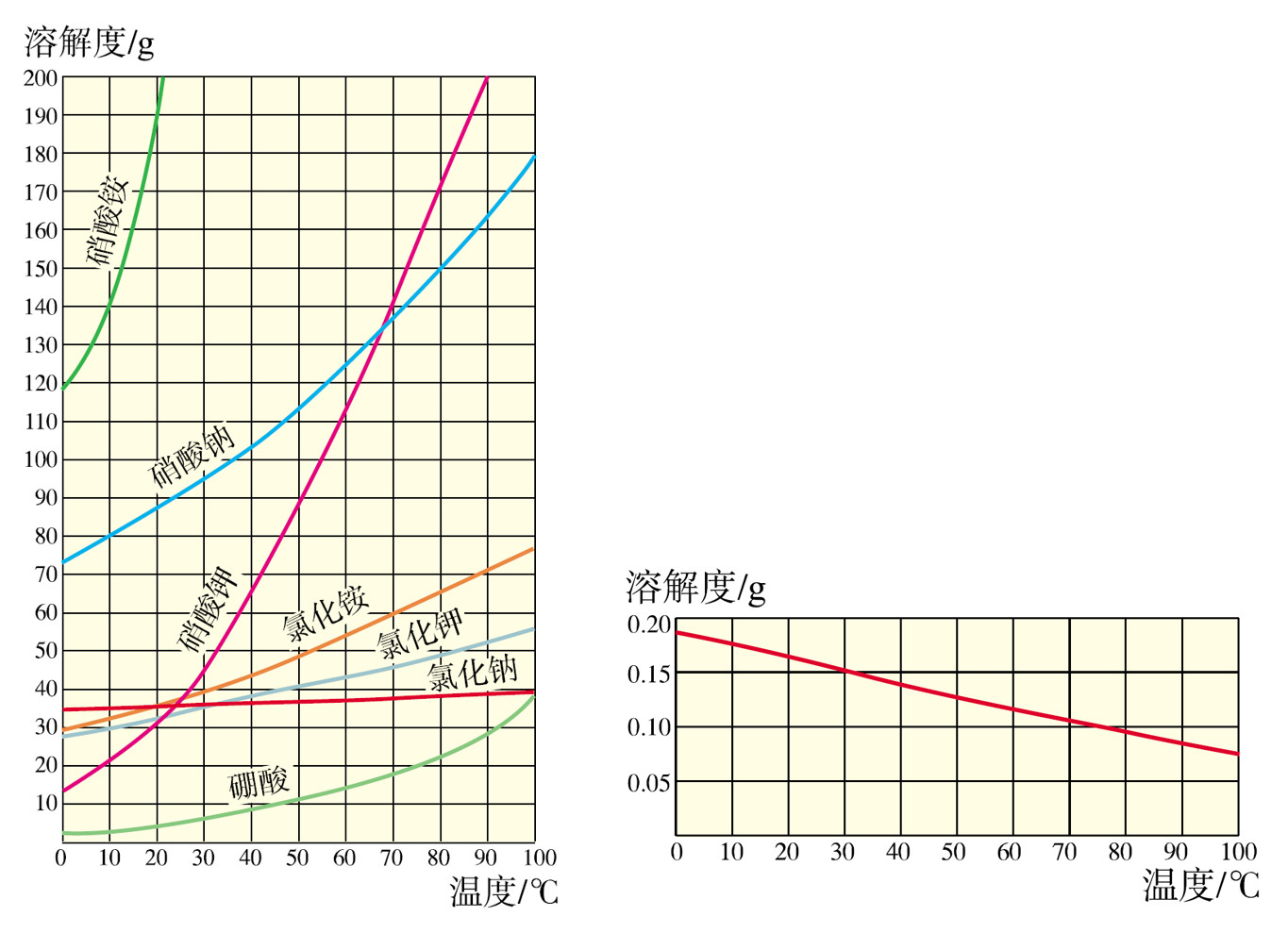
1.溶解度曲线的应用
(1)查出某物质在不同温度时的溶解度
(2)比较不同物质,在同一温度时溶解度的大小
(3)可以比较不同物质的溶解度受温度变化的影响大小
(4)可以看出物质溶解度随温度变化的规律
多数固体物质溶解度随温度升高而增大,如硝酸钾、氯化铵
少数固体物质溶解度受温度变化的影响较小,如氯化钠
极少数固体物质的溶解度随温度升高而减小,如氢氧化钙
五、溶解度与溶解性 (手动水印-微信公众号:每日一化学)
比较20℃时的溶解度
\<0.01g:难溶
0.01g\~1g:微溶
1g\~10g:可溶
>10g:易溶
六、气体溶解度
1.概念
该气体压强为101kpa和一定温度时,在1体积水里溶解达到饱和状态时的气体体积
气体溶解度与压强和温度有关
温度越高,气体溶解度越小
压强越大,气体溶解度越大
9.3 溶质的质量分数
一、浓溶液、稀溶液、饱和溶液、不饱和溶液
浓溶液不一定是饱和溶液
稀溶液不一定是不饱和溶液
浓溶液、稀溶液与饱和溶液、不饱和溶液没有直接关系
二、溶质的质量分数
1.概念
溶液中溶质的质量分数是溶质质量与溶液质量之比
2.公式
溶质的质量分数=$\frac{溶质质量}{溶液质量}$×100%
注意分母是溶液的质量而不是溶剂的质量
溶液质量=溶质质量+溶剂质量
3.饱和溶液溶质质量分数
溶质的质量分数=$\frac{S}{S+100g}$×100%
分析:根据溶液的均一性,饱和溶液溶质的质量分数相等,如果溶剂量为100g,则溶质质量为S,根据溶质质量分数的计算方法可得出上述式子
三、溶液的稀释 (手动水印-微信公众号:每日一化学)
计算依据,稀释前后溶质的总质量不变
1.加水稀释
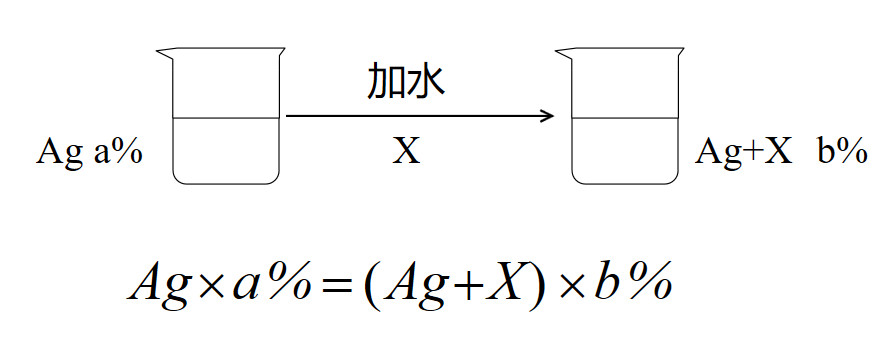
2.加稀溶液稀释(求两种不同浓度溶液混合后溶质质量分数)
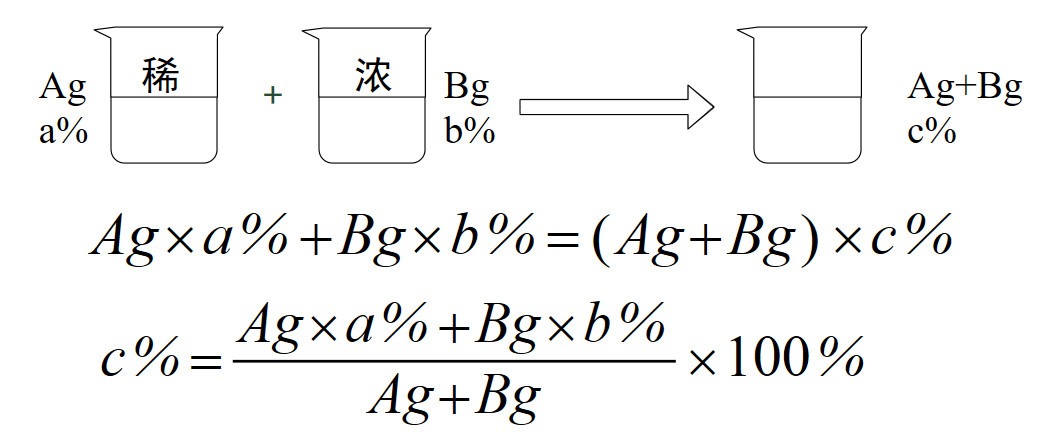
提示:把上述式子看成一个方程,缺哪个量,就设未知数,列方程,求解,即可
第十单元 常见的酸、碱、盐
10.1 溶液的酸碱性
一、酸碱指示剂
1.常见的酸碱指示剂
紫色石蕊溶液:酸红碱蓝
无色酚酞溶液:碱红酸不变
注意:是指示剂变色,而不是酸或碱变色
2.酸碱指示剂能指示出溶液的酸碱性
二、溶液的酸碱度的表示-pH
1.溶液的酸碱度(pH):精确的表示溶液酸碱性强弱程度
pH的范围:0-14
2.pH与溶液酸碱性
酸性溶液:pH<7(值越小,酸性越强)
中性溶液:pH=7
碱性溶液:pH>7(值越大,碱性越强)
3.pH的测定方法
(1)粗略测定:pH试纸(读数为整数)
pH试纸的测定溶液pH的方法:
在白瓷版或玻璃片上放一小片pH试纸,用玻璃棒蘸取溶液滴到pH试纸上,把试纸显示的颜色与标准比色卡比较,读出该溶液的pH
注意: (手动水印-微信公众号:每日一化学)
不能润湿,润湿后酸碱性减弱,酸性溶液pH增大,碱性溶液pH减小(向7靠拢)
不能把pH试纸浸入待测液中,以免污染试剂
三、溶液酸碱度的应用
1.测定人体体液的pH,可帮助人们了解自身的健康状况
2.化工生产中,许多反应在一定pH范围的溶液里进行
3.农业生产:调节土壤pH,改良土壤
4.酸雨:正常雨水的pH≈5.6(空气中二氧化碳与水反应生成碳酸),pH<5.6的雨水称为酸雨。监测雨水的pH可了解空气污染情况
10.2 常见的酸和碱
一、常见的酸
1.常见的酸
盐酸(HCl)、硫酸(H2SO4)、硝酸(HNO3)、醋酸(CH3COOH)、柠檬酸
2.盐酸(HCl气体溶于水形成的溶液)
(1)性质:
①无色有刺激性气味的液体
②挥发性:打开试剂瓶口能观察到白雾(挥发的HCl溶解于水蒸气形成的小液滴)
(2)用途:
①用于金属表面除锈
②胃酸的主要成份,可以帮助消化
3.硫酸 (手动水印-微信公众号:每日一化学)
(1)性质:
①无色无味的液体
②强烈的腐蚀性(脱水性)
③吸水性-做干燥剂
(2)用途:
①金属除锈
②做干燥剂
(3)浓硫酸的稀释
将浓硫酸沿烧杯壁缓慢的注入盛有水的烧杯里,用玻璃棒不断搅拌
口诀:酸入水
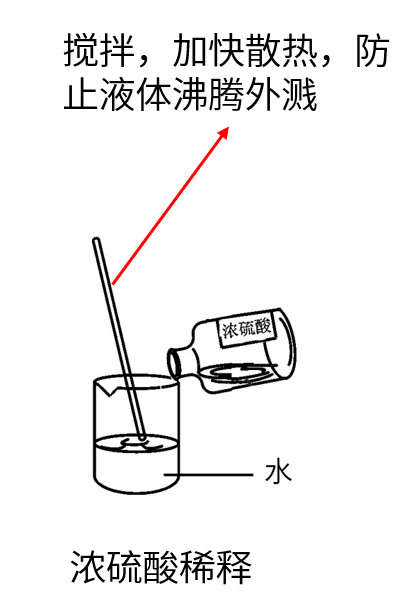
注意:浓硫酸酸沾到皮肤或衣物,用大量水冲洗,涂上3%~5%的碳酸氢钠溶液
4.浓盐酸敞口放置:溶质质量减小,溶剂质量不变,溶质质量分数减小(挥发性)
5.浓硫酸敞口放置:溶质质量不变,溶剂质量增大,溶质质量分数减小(吸水性)
二、酸的化学性质 (手动水印-微信公众号:每日一化学)
1.与指示剂作用
酸能使紫色石蕊溶液变红,不能使无色酚酞溶液变色
2.与活泼金属反应
$\mathrm{\ce{Zn + H2SO4}\xlongequal{}\ce{ZnSO4 + H2 ^}}$
$\mathrm{\ce{Fe + 2HCl}\xlongequal{}\ce{FeCl2 + H2 ^}}$
酸 + 活泼金属 → 盐 + H2
3.与金属氧化物反应
$\ce{Fe2O3 + 6HCl}\xlongequal{}\ce{2FeCl3 + 3H2O}$
现象:铁锈逐渐溶解,溶液由无色变为黄色
$\ce{Fe2O3 + 3H2SO4}\xlongequal{}\ce{Fe2(SO4)3 + 3H2O}$
现象:铁锈逐渐溶解,溶液由无色变为黄色
酸 + 金属氧化物 → 盐 + 水
4.与碱反应
$\ce{NaOH + HCl}\xlongequal{}\ce{NaCl + H2O}$
$\ce{H2SO4 + 2NaOH}\xlongequal{}\ce{Na2SO4 + 2H2O}$
酸 + 碱 → 盐 + 水
5.与盐反应
$\ce{2HCl + Na2CO3}\xlongequal{}\ce{2NaCl + H2O + CO2 ^}$
现象:有大量气泡产生
$\ce{HCl + AgNO3}\xlongequal{}\ce{AgCl v + HNO3}$
现象:有白色沉淀生成
$\ce{H2SO4 + BaCl2}\xlongequal{}\ce{BaSO4 v + 2HCl}$
现象:有白色沉淀生成
酸 + 盐 → 盐 + 酸
三、复分解反应
由两种化合物相互交换成分,生成另外两种化合物的反应
特点:价不变,互交换
通式:AB+CD=AD+CB
四、常见的碱
1.常见的碱
氢氧化钠(NaOH)、氢氧化钙[Ca(OH)2]、氢氧化钾(KOH)、氨水(NH3 ·H2O)
2.氢氧化钠(NaOH)
(1)俗名:火碱、烧碱、苛性钠
(2)性质:
①白色块状固体
②易潮解(容易吸收水分,表面潮湿并逐渐溶解)-作干燥剂
③溶于水放热
④强腐蚀性
注意:如NaOH不慎沾到皮肤上,用大量水冲洗,涂上硼酸溶液
(3)用途: (手动水印-微信公众号:每日一化学)
①干燥剂
②制取肥皂、以及石油、造纸、纺织和印染等工业
③除油污(氢氧化钠能与油脂发生化学反应)
去油污三兄弟:洗涤剂(乳化现象)、汽油(溶解形成溶液)、氢氧化钠(化学反应),新教材删去了乳化现象,思考了一会,还是放在这里
3.氢氧化钙[Ca(OH)2]
(1)俗名:熟石灰、消石灰
(2)性质:
①白色粉末状固体
②微溶于水(水溶液:石灰水;有较多氢氧化钙未溶解:石灰乳、石灰浆)
(3)用途:
①作建筑材料
②含硫磺粉的石灰浆,可保护树木,防冻、防虫
③配制成有杀菌作用的波尔多液(硫酸铜和氢氧化钙)
④改良酸性土壤(不能用NaOH)
制取:
$\ce{CaO + H2O}\xlongequal{}\ce{Ca(OH)2}$
五、碱的化学性质
1.与指示剂作用
碱能使紫色石蕊溶液变蓝,使无色酚酞溶液变红
2.与非金属氧化物反应
吸收二氧化碳:
$\ce{2NaOH + CO2}\xlongequal{}\ce{Na2CO3 + H2O}$
检验二氧化碳:
$\ce{Ca(OH)2 + CO2}\xlongequal{}\ce{CaCO3 v + H2O}$
现象:澄清石灰水变浑浊
碱 + 非金属氧化物 → 盐 + 水
3.与酸反应
$\ce{2NaOH + H2SO4}\xlongequal{}\ce{Na2SO4 + 2H2O}$
$\ce{Ca(OH)2 + 2HCl}\xlongequal{}\ce{CaCl2 + 2H2O}$
碱 + 酸 → 盐 + 水
4.与盐反应
$\ce{2NaOH + CuSO4}\xlongequal{}\ce{Na2SO4 + Cu(OH)2 v}$
现象:有蓝色絮状沉淀生成
$\ce{3NaOH + FeCl3}\xlongequal{}\ce{3NaCl + Fe(OH)3 v}$
现象:有红褐色沉淀生成
$\ce{Ca(OH)2 + Na2CO3}\xlongequal{}\ce{CaCO3 v + 2NaOH}$
现象:有白色沉淀生成
碱 + 盐 → 盐 + 碱
六、酸、碱具有相似化学性质的原因
1.酸具有通性的原因:在水中都会解离出H +
2.碱具有通性的原因:在水中都会解离出OH -
七、中和反应 (手动水印-微信公众号:每日一化学)
1.什么是酸碱盐
酸:在水中解离的阳离子只有H+的化合物
碱:在水中解离的阴离子只有OH-的化合物
盐:金属离子(或铵根离子)与酸根离子构成的化合物
2.概念:酸与碱作用生成盐和水的反应,叫做中和反应
3.中和反应的实质:氢离子和氢氧根离子结合生成水分子
H + + OH - =H2O
4.实验
(1)步骤:在烧杯中加入约5ml氢氧化钠溶液,滴入几滴酚酞溶液,用滴管缓慢的滴入稀盐酸,并不断搅拌溶液,至溶液恰好变为无色
(2)解释:稀盐酸和氢氧化钠溶液反应,无明显的现象。通过滴加酚酞溶液来证明确实发生了化学反应。因为氢氧化钠溶液能使酚酞溶液变红,但是滴加稀盐酸后,红色消失了,证明氢氧化钠消失了,转变为了其他物质,以此证明氢氧化钠和稀盐酸确实发生化学反应。我们在证明两种物质发生了化学反应时,除了可以证明有新物质生成,还可以通过证明反应物消失了来证明化学反应的发生
5.中和反应举例
$\ce{NaOH + HCl}\xlongequal{}\ce{NaCl + H2O}$
$\ce{H2SO4 + 2NaOH}\xlongequal{}\ce{Na2SO4 + 2H2O}$
$\ce{Ca(OH)2 + 2HCl}\xlongequal{}\ce{CaCl2 + 2H2O}$
6.中和反应在实际中的应用
①治疗胃酸(盐酸)过多
$\ce{Al(OH)3 + 3HCl}\xlongequal{}\ce{AlCl3 + 3H2O}$
②蚊虫叮咬,分泌蚁酸,涂抹碱性(肥皂水)物质,减轻痛痒
③利用中和反应处理工厂废水
$\ce{Ca(OH)2 + H2SO4}\xlongequal{}\ce{CaSO4 + 2H2O}$
④利用中和反应,调节土壤的酸碱性
10.3 常见的盐
一、常见的盐
盐:金属离子(铵根离子)与酸根离子构成的化合物
如:氯化钠(NaCl)、碳酸钠(Na2CO3)、碳酸氢钠(NaHCO3)、碳酸钙(CaCO3)、高锰酸钾(KMnO4)、硫酸铜(CuSO4)、硝酸钠(NaNO3)
1.氯化钠(NaCl)
(1)NaCl是食盐的主要成分
(2)用途:
调味品、维持人的正常生理活动、医疗上配置生理盐水、用NaCl溶液选种、腌制食品、工业原料、消除公路积雪、
(3)资源分布
海水、盐湖、盐井、盐矿
(4)制法 (手动水印-微信公众号:每日一化学)
晾晒海水、煮盐井水、盐湖水,蒸发除去水分得到粗盐
粗盐中含有多种可溶性杂质(氯化镁、氯化钙)和不溶性杂质(泥沙)
粗盐通过溶解、沉淀、过滤、蒸发、结晶,可以得到初步提纯
2.Na2CO3
(1)俗名:苏打、纯碱
(2)用途:广泛用于玻璃、造纸、纺织和洗涤剂的生产
3.NaHCO3
(1)俗名:小苏打
(2)用途:发酵粉的主要成分,治疗胃酸过多
4.CaCO3
(1)大理石、石灰石、鸡蛋壳的主要成分
(2)用途:做建筑材料、补钙剂、制牙膏
二、碳酸盐的化学性质
1.与酸反应
$\ce{2HCl + Na2CO3}\xlongequal{}\ce{2NaCl + H2O + CO2 ^}$
$\ce{HCl + NaHCO3}\xlongequal{}\ce{NaCl + H2O + CO2 ^}$
2.碳酸钠与氢氧化钙反应
$\ce{Ca(OH)2 + Na2CO3}\xlongequal{}\ce{CaCO3 v + 2NaOH}$
3.CO32-的检验
加稀盐酸-有大量气泡产生
将产生的气体通入澄清石灰水-澄清石灰水变浑浊
三、复分解反应
由两种化合物相互交换成分,生成另外两种化合物的反应
特点:价不变,互交换
通式:AB+CD=AD+CB
四、溶解性口诀
钾钠铵盐硝酸盐,都能溶于水中间
盐酸盐不溶只有银,硫酸盐不溶只有钡
碳酸盐只溶铵钾钠,碱只溶铵钾钠钡
五、复分解反应5大类
1.酸与金属氧化物反应
2.酸与碱反应
3.酸与盐反应
4.碱与盐反应
5.盐与盐反应
在初中化,复分解反应主要就是酸、碱、盐、金属氧化物之间的反应
大家碰到酸、碱、盐、金属氧化物之间的反应,可直接按照复分解反应的书写规律去写出相应的化学方程式
六、复分解反应发生的条件
只有当两种化合物相互交换成分,有气体或有沉淀或有水生成时,才是发生了复分解反应
气体:碳酸盐与酸,铵盐与碱
沉淀(常用8大沉淀):氯化银、硫酸钡、碳酸钙、碳酸钡、氢氧化镁、氢氧化铝、氢氧化铜(蓝色絮状沉淀)、氢氧化铁(红褐色沉淀)
水:酸与金属氧化物、酸与碱
七、盐的化学性质 (手动水印-微信公众号:每日一化学)
1.盐 + 金属 → 盐 + 金属
2.盐 + 酸 → 盐 + 酸
3.盐 + 碱 → 盐 + 碱
4.盐 + 盐 → 盐 + 盐
$\ce{CuSO4 + BaCl2}\xlongequal{}\ce{BaSO4 v + CuCl2}$
$\ce{Na2CO3 + CaCl2}\xlongequal{}\ce{CaCO3 v + 2NaCl}$
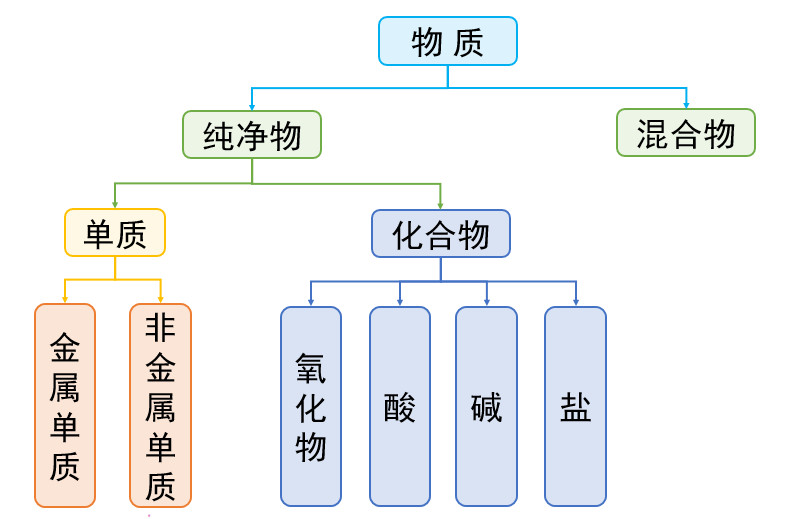
八、物质分类
九、化肥简介
农家肥:人畜粪便、植物体等
化学肥料:以化学和物理方法制成,含农作物生长所需营养元素(氮肥、磷肥、钾肥)
1.氮肥 (手动水印-微信公众号:每日一化学)
(1)作用:促进植物茎、叶生长茂盛,叶色浓绿,提高植物蛋白质的含量
(2)举例:
尿素:CO(NH2)2
氨水:NH3·H2O
碳酸氢铵:NH4HCO3(不稳定,易分解能闻到氨味)
$\ce{NH4HCO3}\xlongequal{}\ce{NH3 ^ + H2O +CO2 ^}$
氯化铵:NH4Cl
硝酸铵:NH4NO3
硝酸钠:NaNO3
2.磷肥
(1)作用:增强作物抗寒、抗旱能力
(2)举例:
磷矿粉:Ca3(PO4)2
钙镁磷肥:钙和镁的磷酸盐
过磷酸钙:Ca(H2PO4)2和CaSO4的混合物
3.钾肥
(1)作用:增强抗病虫害和抗倒伏能力
(2)举例:
硫酸钾:K2SO4
氯化钾:KCl
氮、磷、钾肥
功效的口诀:钾抗倒伏,磷抗旱,茎、叶茂盛要用氮
4.复合肥
化肥中同时还有氮、磷、钾中的两种或三种营养元素
举例:
磷酸二氢铵:NH4H2PO4
磷酸氢二铵:(NH4)2HPO4
硝酸钾:KNO3
十、化肥、农药的利与弊
1.利
化肥:提高农作物产量
农药:消灭病虫害、杂草等,促高产、丰收
2.弊
土壤污染、水污染、大气污染、危害健康
3.农药化肥的使用
均衡适度、适时用药、减少污染
十一、侯氏制碱法
制取的是纯碱:Na2CO3
第十一单元 化学与社会
11.1 化学与人体健康
一、人体中的元素
1.常量元素
人体内含量超过0.01%的元素,称为常量元素
常量元素由11种:O、C、H、N、Ca、P、K、S、Na、Cl、Mg
2.微量元素
含量在0.01%以下的元素,称为微量元素
Fe、Zn、F、I等
3.有机物化合物与无机化合物
有机化合物(有机物):含有碳元素的化合物
无机化合物(无机物):不含碳元素的化合物
特例:CO、CO2 (碳的氧化物)、含CO3的化合物,是无机物,不属于有机物
二、化学元素与人体健康 (手动水印-微信公众号:每日一化学)
1.常量元素
(1)K:维持体内酸碱平衡和神经、肌肉的功能,钾缺乏会引起肌肉无力和心率失常,影响肾功能
(2)Na:维持体内水量的恒定,酸碱平衡和血压,缺钠会引起血压降低和肌肉痉挛,摄入过多会增加高血压和心血管疾病风险
(3)Ca:人体骨骼和牙齿的重要成分。幼儿青少年缺钙患佝偻病,导致生长发育不良,老年人缺钙会导致骨质疏松和骨折
2.微量元素
(1)必需元素:不足、过量均不利于健康
Fe:缺铁性贫血
F:缺乏:龋齿;过量:氟斑牙、氟骨病
I:甲状腺肿大
我们所说的补铁、补钙、补锌、加碘食盐都是指的元素
3.有害元素:Hg、Pb、Cd等
三、合理膳食
1.食物中的六大营养素
蛋白质、糖类、油脂、维生素、无机盐、水
2.糖类
(1)举例:淀粉: (C6H10O5 )n 、葡萄糖:C6H12O6
(2)功能:人体主要的供能物质
$\ce{C6H12O6 + 6O2}\xlongequal{酶}\ce{6CO2 + 6H2O}$
3.蛋白质
食物中的蛋白质在消化道与水反应生成氨基酸
一部分氨基酸重新形成人体所需要的多种蛋白质,促进生长发育
另一部分氨基酸被氧化生成尿素、二氧化碳、水,同时放出能量
4.油脂
(1)油脂是油和脂肪的合称
植物油呈液态,称为油
动物油呈固态,称为脂肪
(2)功能:脂肪是重要的备用能源
四、合理用药
11.2 化学与可持续发展
一、化学与能源利用
1.将化石能源转化为清洁、便利的二次能源
2.开发可再生和环境友好的新能源
举例:煤的清洁利用、电解水制氢、风力发电机、光伏电池、燃料电池、电动汽车锂离子电池
二、化学与材料开发
1.高分子材料都是由大量小分子聚合而成的聚合物,具有链状结构和网状结构
2.高分子:相对分子质量比较大(通常在1万以上)
3.合成材料(人工合成高分子材料)
(1)塑料 (手动水印-微信公众号:每日一化学)
主要性能:密度小,耐腐蚀,易加工
常见类型:聚乙烯、聚丙烯、聚氯乙烯、聚苯乙烯、聚酯
应用举例:绝缘材料、包装材料、农用薄膜、管道、机械零件
(2)合成橡胶
主要性能:弹性和绝缘性号
常见类型:顺丁橡胶、丁苯橡胶、异戊橡胶、硅橡胶
应用举例:轮胎、密封制品、防护用品
(3)合成纤维
主要性能:强度高,弹性好,耐磨,耐腐蚀
常见类型:丙纶、涤纶、腈纶
应用举例:纺织原料、过滤材料、建筑材料
4.天然材料(天然高分子材料)
(1)天然橡胶
(2)天然纤维:棉花、羊毛
5.复合材料
将几种材料复合起来,综合各组分性能的优点形成的材料
举例:碳纤维复合材料、玻璃纤维增强塑料(玻璃钢)、芳纶复合材料
6.几种常见的材料归纳
(1)金属材料:钢铁、铝合金
(2)无机非金属材料:玻璃、陶瓷、水泥
(3)高分子材料
①天然材料:天然橡胶、天然纤维
②合成材料:塑料、合成纤维、合成橡胶
(4)复合材料:碳纤维复合材料、玻璃纤维增强塑料(玻璃钢)、芳纶复合材料
7.天然纤维、合成纤维的鉴别
鉴别方法:灼烧闻气味
羊毛:烧焦羽毛味
棉花:烧纸的气味
合成纤维:特殊气味